http://www.ptable.com/?lang=es
http://definicion.de/tabla-periodica/
Introducción
Ahora en nuestra actualidad la tabla periódica ya no posee la misma organización de elementos como antes, ahora ya se dividen en grupos las cuales son las columnas que observamos en alguna tabla periódica las cuales son 18 grupos y cada grupo le corresponde un nombre que caracteriza a todos los integrantes del mismo, como también están divididos en periodos las cuales son las filas que observamos en la tabla periódica y que son 7 periodos, pero sucede que el periodo 6 y 7 se une a la última tabla que se encuentra debajo de la otra tabla más grande la cual forma un total de 7 periodos y cada periódico se caracteriza que cada elemento está ordenado de forma que aquellos con propiedades químicas semejantes, se encuentren situados cerca uno de otro, pues conoceremos todo esta información adentrándonos a la lectura del siguiente tema la cual se detalló los más importante que encontraran en ello.
La Tabla Periódica
-
Historia de la tabla Periódica:
En 1829 el químico alemán Döbereiner realizo el primer intento de establecer una ordenación en los elementos químicos, haciendo notar en sus trabajos las similitudes entre los elementos cloro, bromo e iodo por un lado y la variación regular de sus propiedades por otro.
Una de las propiedades que parecía variar regularmente entre estos era el peso atómico.
Desde 1850 hasta 1865 se descubrieron muchos elementos nuevos y se hicieron notables progresos en la determinación de las masas atómicas, además, se conocieron mejor otras propiedades de los mismos.
Fue en 1864 cuando estos intentos dieron su primer fruto importante, cuando Newlands estableció la ley de las octavas. Habiendo ordenado los elementos conocidos por su peso atómico y después de disponerlos en columnas verticales de siete elementos cada una, observó que en muchos casos coincidían en las filas horizontales elementos con propiedades similares y que presentaban una variación regular.
Esta ordenación, en columnas de siete da su nombre a la ley de las octavas, recordando los periodos musicales. En algunas de las filas horizontales coincidían los elementos cuyas similitudes ya había señalado Döbereiner. El fallo principal que tuvo Newlands fue el considerar que sus columnas verticales (que serían equivalentes a períodos en la tabla actual) debían tener siempre la misma longitud. Esto provocaba la coincidencia en algunas filas horizontales de elementos totalmente dispares y tuvo como consecuencia el que sus trabajos fueran desestimados.
En 1869 el químico alemán Julius Lothar Meyer y el químico ruso Dimitri Ivanovich Mendelyev propusieron la primera "Ley Periódica".
Meyer al estudiar los volúmenes atómicos de los elementos y representarlos frente al peso atómico observó la aparición en el gráfico de una serie de ondas. Cada bajada desde un máximo (que se correspondía con un metal alcalino) y subido hasta el siguiente, representaba para Meyer un periodo. En los primeros periodos, se cumplía la ley de las octavas, pero después se encontraban periodos mucho más largos.
Utilizando como criterio la valencia de los distintos elementos, además de su peso atómico, Mendelyev presentó su trabajo en forma de tabla en la que los periodos se rellenaban de acuerdo con las valencias (que aumentaban o disminuían de forma armónica dentro de los distintos periodos) de los elementos.
Esta ordenación daba de nuevo lugar a otros grupos de elementos en los que coincidían elementos de propiedades químicas similares y con una variación regular en sus propiedades físicas.
La tabla explicaba las observaciones de Döbereiner, cumplía la ley de las octavas en sus primeros periodos y coincidía con lo predicho en el gráfico de Meyer. Además, observando la existencia de huecos en su tabla, Mendelyev dedujo que debían existir elementos que aún no se habían descubierto y además adelanto las propiedades que debían tener estos elementos de acuerdo con la posición que debían ocupar en la tabla.
-
El descubrimiento de los elementos:
Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y el mercurio (Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo XVII cuando el alquimista Henning Brand descubrió el fósforo (P).
En el siglo XVIII se conocieron numerosos nuevos elementos, los más importantes de los cuales fueron los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos. A principios del siglo XIX, la aplicación de la pila eléctrica al estudio de fenómenos químicos condujo al descubrimiento de nuevos elementos, como los metales alcalinos y alcalino–térreos, sobre todo gracias a los trabajos de Humphry Davy.
En 1830 ya se conocían 55 elementos. Posteriormente, a mediados del siglo XIX, con la invención del espectroscopio, se descubrieron nuevos elementos, muchos de ellos nombrados por el color de sus líneas espectrales características: cesio (Cs, del latín caesius, azul), talio (Tl, de tallo, por su color verde), rubidio (Rb, rojo), etc.
-
Antes de 1800 (34 elementos): descubrimientos durante y antes del Siglo de las Luces.
-
1800-1849 (+24 elementos): Revolución científica y Revolución industrial.
-
1850-1899 (+26 elementos): el periodo de las clasificaciones de los elementos recibió el impulso del análisis de los espectros: Boisbaudran, Bunsen, Crookes, Kirchhoff, y otros "cazadores de trazas en las líneas de emisión de los espectros".
-
1900-1949 (+13 elementos): impulso con la antigua teoría cuántica y la mecánica cuántica.
-
1950-2000 (+17 elementos): descubrimientos "después de la bomba atómica": elementos de números atómicos 98 y posteriores (colisionadores, técnicas de bombardeo).
-
2001-presente (+4 elementos): descubrimientos muy recientes, que no están confirmados.
-
La noción de elemento y las propiedades periódicas:
La palabra "elemento" procede de la ciencia griega, pero su noción moderna apareció a lo largo del siglo XVII, aunque no existe un consenso claro respecto al proceso que condujo a su consolidación y uso generalizado. Algunos autores citan como precedente la frase de Robert Boyle en su famosa obra El químico escéptico, donde denomina elementos "ciertos cuerpos primitivos y simples que no están formados por otros cuerpos, ni unos de otros, y que son los ingredientes de que se componen inmediatamente y en que se resuelven en último término todos los cuerpos perfectamente mixtos". En realidad, esa frase aparece en el contexto de la crítica de Robert Boyle a los cuatro elementos aristotélicos.
A lo largo del siglo XVIII, las tablas de afinidad recogieron un nuevo modo de entender la composición química, que aparece claramente expuesto por Lavoisier en su obra Tratado elemental de química. Todo ello condujo a diferenciar en primer lugar qué sustancias de las conocidas hasta ese momento eran elementos químicos, cuáles eran sus propiedades y cómo aislarlas.
El descubrimiento de gran cantidad de elementos nuevos, así como el estudio de sus propiedades, pusieron de manifiesto algunas semejanzas entre ellos, lo que aumentó el interés de los químicos por buscar algún tipo de clasificación.
-
Los pesos atómicos:
Los valores de estos pesos atómicos estándar están reimpresos en una amplia variedad de libros de texto, catálogos comerciales, póster, etcétera. Para describir esta cantidad física se puede usar también la expresión masa atómica relativa. En consecuencia, desde por lo menos 1860 y hasta el decenio de 1960, el uso continuado de la locución ha atraído una controversia considerable.
A diferencia de las masas atómicas (las masas de los átomos individuales), los pesos atómicos no son constantes físicas. Varían de una muestra a otra. Sin embargo, en muestras normales son suficientemente constantes para ser de importancia fundamental en química. Se ha de no confundir al peso atómico con la masa atómica.
El peso atómico fue desarrollado por John Dalton en el siglo XIX, su aporte consistió en la formulación de un atomismo químico que integraba el elemento y las leyes ponderales. Este científico, tomo sustancias de su época y supuso como se combinaban los átomos de estas, tomo como referencia la masa de una átomo de hidrogeno y a partir de experiencias y suposiciones construyó la primera tabla de masas atómicas relativas. Esta tabla se perfecciono con el congreso de karlsruhe en 1860. Dalton empleó los conocimientos sobre proporciones en las que reaccionaban las sustancias de su época y realizó algunas suposiciones sobre el modo como se combinaban los átomos de las mismas.
Por ejemplo, en el caso del oxígeno, Dalton partió de la suposición de que el agua era un compuesto binario, formado por un átomo de hidrógeno y otro de oxígeno. No tenía ningún modo de comprobar este punto, por lo que tuvo que aceptar esta posibilidad como una hipótesis a priori.
Dalton sabía que 1 parte de hidrógeno se combinaba con 7 partes (8 afirmaríamos en la actualidad) de oxígeno para producir agua. Por lo tanto, si la combinación se producía átomo a átomo, es decir, un átomo de hidrógeno se combinaba con un átomo de oxígeno, la relación entre las masas de estos átomos debía ser 1:7 (o 1:8 se calcularía en la actualidad). El resultado fue la primera tabla de masas atómicas relativas (o pesos atómicos, como los llamaba Dalton) que fue posteriormente modificada y desarrollada en los años posteriores. Las inexactitudes antes mencionadas dieron lugar a toda una serie de polémicas y disparidades respecto a las fórmulas y los pesos atómicos, que solo comenzarían a superarse, aunque no totalmente, en el congreso de Karlsruhe en 1860.
-
Metales, no metales y metaloides o metales de transición:

-
Antoine-Laurent de Lavoisier
químico, biólogo y economista francés,
considerado el creador de la química moderna, junto a
su esposa, la científica Marie-Anne Pierrette
Paulze, por sus estudios sobre la oxidación de los
cuerpos, el fenómeno de la respiración animal,
el análisis del aire, la ley de
conservación de la masa o ley
Lomonósov-Lavoisier, la teoría
calórica y la combustión.
-
Se llama metales a
los elementos químicos caracterizados
por ser buenos conductores del calor y la
electricidad. Poseen alta densidad y son sólidos en
temperaturas normales (excepto el mercurio); sus sales
forman iones electropositivos (cationes) en
disolución.

-
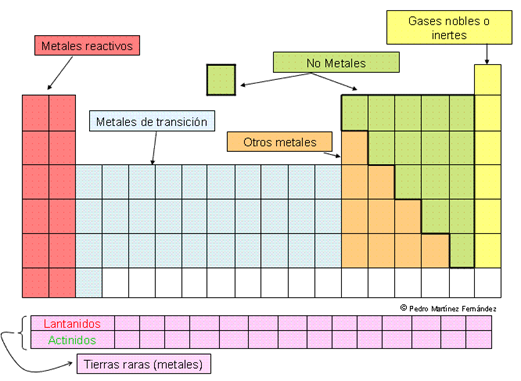
Metales reactivos. Se denomina así a los
elementos de las dos primeras columnas (alcalinos y
alcalinotérreos) al ser los metales más
reactivos por regla general.
-
Metales de transición. Son los elementos que
se encuentran entre las columnas largas, tenemos los de
transición interna (grupos cortos) y transición
externa o tierras raras (lantánidos y
actínidos).
-
Otros metales. Son los que se encuentran en el resto
de grupos largos. Algunos de ellos tienen propiedades de no
metal en determinadas circunstancias (semimetales o
metaloides).
-
Propiedades de los metales.
-
Son buenos conductores de la
electricidad.
-
Son buenos conductores del calor.
-
Son resistentes y duros.
-
Son brillantes cuando se frotan o al
corte.
-
Son maleables, se convierten con facilidad en
láminas muy finas.
-
Son dúctiles, se transforman con facilidad en
hilos finos.
-
Se producen sonidos característicos (sonido
metálico) cuando son golpeados.
-
Tienen altos puntos de fusión y de
ebullición.
-
Poseen elevadas densidades; es decir, tienen mucha
masa para su tamaño: tienen muchos átomos
juntos en un pequeño volumen.
-
Algunos metales tienen propiedades
magnéticas: son atraídos por los
imanes.
-
Pueden formar aleaciones cuando se mezclan
diferentes metales. Las aleaciones suman las propiedades de
los metales que se combinan. Así, si un metal es
ligero y frágil, mientras que el otro es pesado y
resistente, la combinación de ambos podrías
darnos una aleación ligera y resistente.
-
Tienen tendencia a formar iones
positivos.
Hay algunas excepciones a las propiedades
generales enunciadas anteriormente:
-
El mercurio es un metal pero es líquido a temperatura ambiente.
-
El sodio es metal pero es blando (se raya con facilidad) y flota (baja densidad)
-
Se denomina no metales, a
los elementos químicos opuestos a
los metales pues sus características son
totalmente diferentes. Los no metales, excepto el
hidrógeno, están situados en la tabla
periódica de los elementos en
el bloque p. Los elementos de este bloque
son no-metales, excepto los metaloides (B, Si, Ge,
As, Sb, Te), todos los gases nobles (He, Ne, Ar,
Kr, Xe, Rn), y algunos metales (Al, Ga, In, Tl, Sn,
Pb).

-
Propiedades de los no metales:
-
Son malos conductores de la electricidad.
-
Son malos conductores del calor.
-
Son poco resistentes y se desgastan con
facilidad.
-
No reflejan la luz como los metales, no tienen el
denominado brillo metálico. Su superficie no es tan
lisa como en los metales.
-
Son frágiles, se rompen con
facilidad.
-
Tienen baja densidad.
-
No son atraídos por los imanes.
-
Tienen tendencia a formar iones
negativos.
-
El diamante es un no metal pero presenta una gran
dureza.
-
El grafito es un no metal pero conduce la
electricidad.
-
Los elementos de
transición son aquellos elementos
químicos que están situados en la parte
central del sistema periódico, en el bloque
d, cuya principal característica es la
inclusión en su configuración
electrónica del orbital d,
parcialmente lleno de electrones. Esta definición
se puede ampliar considerando como elementos de
transición a aquellos que poseen electrones alojados
en el orbital d, esto incluiría
a zinc, cadmio, y mercurio.
La IUPAC define un metal de transición como
"un elemento cuyo átomo tiene una subcapa d incompleta
o que puede dar lugar a cationes".

-
Los elementos que no se pueden clasificar como
metales o como no metales; tienen propiedades de los dos
grupos y se les llaman metaloides o semimetales. Estos
son el boro (B) del grupo IIA, silicio (Si) del grupo IVA,
germanio (Ge) del grupo IVA, arsénico (As) del grupo
IVA, antimonio (Sb) del grupo VA y telurio (Te) del grupo
VIA.

Se encuentran entre lo metales y los no metales (B, Si, Ge, As, Sb, Te, Po). Son sólidos a temperatura ambiente y forman iones positivos con dificultad. Según las circunstancias tienen uno u otro comportamiento.
Clasificación
-
 Grupos:
Grupos:
Todos los elementos que pertenecen a un grupo tienen la misma valencia atómica, entendido como el número de electrones en la última capa, y por ello, tienen propiedades similares entre sí.
La explicación moderna del ordenamiento en la tabla periódica es que los elementos de un grupo poseen configuraciones electrónicas similares y la misma valencia atómica, o número de electrones en la última capa.
Dado que las propiedades químicas dependen profundamente de las interacciones de los electrones que están ubicados en los niveles más externos, los elementos de un mismo grupo tienen propiedades químicas similares.
Por ejemplo, los elementos en el grupo 1 tienen una configuración electrónica y una valencia de 1 (un electrón externo) y todos tienden a perder ese electrón al enlazarse comoiones positivos de +1. Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen lleno su último nivel de energía (regla del octeto) y, por ello, son excepcionalmente no reactivos y son también llamados gases inertes.
Numerados de izquierda a derecha utilizando números arábigos, según la última recomendación de la IUPAC (según la antigua propuesta de la IUPAC) de 1988 y entre paréntesis según el sistema estadounidense,9 los grupos de la tabla periódica son:

-
Grupo 1 (IA), Metales
Alcalinos:
Con excepción del hidrógeno, son todos blancos, brillantes, muy activos, y se les encuentra combinados en forma de compuestos. Se les debe guardar en la atmósfera inerte o bajo aceite.
Los compuestos de los metales alcalinos son isomorfos, lo mismo que los compuestos salinos del amonio. Este radical presenta grandes analogías con los metales de este grupo.
Estos metales, cuyos átomos poseen un solo electrón en la capa externa, son monovalentes. Dada su estructura atómica, ceden fácilmente el electrón de valencia y pasan al estado iónico. Esto explica el carácter electropositivo que poseen, así como otras propiedades.
Los de mayor importancia son el sodio y el potasio, sus sales son empleadas industrialmente en gran escala.
-
Grupo 2 (IIA), Metales
Alcalinotérreos:
El radio es un elemento radiactivo.
Estos elementos son muy activos aunque no tanto como los del grupo I. Son buenos conductores del calor y la electricidad, son blancos y brillantes.
Como el nombre indica, manifiestan propiedades intermedias entre los metales alcalinos y los térreos; el magnesio y, sobre todo, el berilio son los que más se asemejan a estos.
No existen en estado natural, por ser demasiado activos y, generalmente, se presentan formando silicatos, carbonatos, cloruros y sulfatos, generalmente insolubles.
Estos metales son difíciles de obtener, por lo que su empleo es muy restringido.
-
Grupo 3 (IIIB), familia del
Escandio:
La familia del escandio se
compone de todos los integrantes del Grupo 3 de la tabla
periódica (antiguamente III B):
Escandio (Sc)
Itrio (Y)
Lantano (La)
Actinio (Ac)
Elementos de transición
interna (Actínidos y Lantánidos o Tierras
raras)Tendencia a oxidarse y ser muy reactivos. Propiedades
similares al aluminio. Dan lugar a iones incoloros.
-
Grupo 4 (IVB), Familia
del Titanio:
Titanio (Ti)
Circonio (Zr)
Hafnio (Hf)
Rutherfordio (Rf)
Estos metales son bastante reactivos (sobre todo cuando están en forma de esponja porosa, de gran superficie específica, son pirofóricos; esto es, al exponerse a la acción del aire se vuelven rojos e inflaman espontáneamente). Al estar compactos son pasivos, casi inatacables por cualquier agente atmosférico.
-
Grupo 5 (VB), familia del Vanadio:
Vanadio (V)
Niobio (Nb)
Tantalo (Ta)
Dubnio (Db)
Todos los elementos de este grupo tienen comportamientos representativos del nombre que los representa, en este caso es el vanadio.
-
Grupo 6 (VIB), familia del Cromo:
Cromo (Cr)
Molibdeno (Mo)
Volframio o Tungsteno (W)
Seaborgio (Sg)
Todos los elementos de este grupo tienen comportamientos representativos del nombre que los representa. En este caso es el cromo.
-
Grupo 7 (VIIB), familia del
Manganeso:
Manganeso (Mn)
Tecnecio (Tc)
Renio (Re)
Bohrio (Bh)
Todos los elementos de este grupo tienen comportamientos representativos del nombre que los representa. En este caso es el manganeso.
-
Grupo 8 (VIIIB), familia del
Hierro:
Hierro (Fe)
Rutenio (Ru)
Osmio (Os)
Hassio (Hs)
Todos los elementos de este grupo tienen comportamientos físico-químicos representativos del nombre que los representa. En este caso es el hierro.
-
Grupo 9 (IXB), familia del
Cobalto:
Cobalto (Co)
Rodio (Rh)
Iridio (Ir)
Meitnerio (Mt)
Todos los elementos de este grupo tienen comportamientos físico-químicos representativos del nombre que los representa. En este caso es el cobalto.

-
Grupo 10 (XB), familia del
Níquel:
Níquel (Ni)
Paladio (Pd)
Platino (Pt)
Darmstadio (Ds) (anteriormente Ununnilio (Uun))
Todos los elementos de este grupo tienen comportamientos físico-químicos representativos del nombre que los representa. En este caso es el níquel.
-
Grupo 11 (IB), familia del Cobre:
Cobre (Cu)
Plata (Ag)
Oro (Au)
Roentgenio (Rg) o Unununium (Uuu)
Todos los elementos de este grupo tienen comportamientos físico-químicos representativos del nombre que los representa. En este caso es el Cobre.
-
Grupo 12 (IIB), familia del Cinc:
Zinc (Zn)
Cadmio (Cd)
Mercurio (Hg)
Copernicio (Cn) (anteriormente Ununbio (Uub))
Todos los elementos de este grupo tienen comportamientos físico-químicos representativos del nombre que los representa en este caso es el zinc.
-
Grupo 13 (IIIA), Los
Térreos:
El siguiente elemento, el aluminio, forma fácilmente óxidos al exponerse al aire, y la capa de óxido que se deposita lo hace menos reactivo que el aluminio elemental. El aluminio también reacciona con el ácido clorhídrico (HCl) desprendiendo hidrógeno. Los restantes elementos del grupo tienden a perder solo los electrones de los orbitales p (1) formando iones unipositivos.
Estos metales forman también compuestos moleculares lo que muestra la variación gradual dentro de la tabla desde el carácter metálico al no metálico.
-
Grupo 14 (IVA), Los Carbonoideos:
La mayoría de los elementos de este grupo son muy conocidos y difundidos, especialmente el carbono, elemento fundamental de la química orgánica. A su vez, el silicio es uno de los elementos más abundantes en la corteza terrestre (28%), y de gran importancia en la sociedad a partir del siglo XXI, ya que es el elemento principal de los circuitos integrados.
Al bajar en el grupo, estos elementos van teniendo características cada vez más metálicas: el carbono es un no metal, el silicio y el germanio son semimetales, y el estaño y el plomo son metales.

-
Grupo 15 (VA), Los Nitrogenoideos:
-
Grupo 16 (VIA), los Calcógenos o
Anfígenos:
El grupo de los anfígenos o calcógenos es también llamado familia del oxígeno y es el grupo conocido antiguamente como VIA, y actualmente grupo 16 (según la IUPAC) en la tabla periódica de los elementos, formado por los siguientes elementos: oxígeno (O), azufre (S), selenio (Se),telurio (Te) y polonio (Po).
Aunque todos ellos tienen seis electrones de valencia (última capa s2p4), sus propiedades varían de no metálicas a metálicas en cierto grado, conforme aumenta su número atómico.
El oxígeno y el azufre se utilizan abiertamente en la industria y el telurio y el selenio en la fabricación de semiconductores.
-
Grupo 17 (VIIA), Halógenos:
Los formadores de sal se encuentran combinados en la naturaleza por su gran actividad. Las sales de estos elementos con los de los grupos I y II están en los mares. Las propiedades de los halógenos son muy semejantes. La mayoría se sus compuestos derivados son tóxicos, irritantes, activos y tienen gran aplicación tanto en la industria como en el laboratorio.
El astatinio o ástato difiere un poco del resto del grupo.
-
Grupo 18 (VIIIA), Los Gases
Nobles:
Las propiedades de los gases nobles pueden ser explicadas por las teorías modernas de la estructura atómica: a su capa electrónica de electrones valentes se la considera completa, dándoles poca tendencia a participar en reacciones químicas, por lo que sólo unos pocos compuestos de gases nobles han sido preparados hasta 2008.
El neón, argón, kriptón y xenón se obtienen del aire usando los métodos de licuefacción y destilación fraccionada. El helio es típicamente separado del gas natural y el radón se aísla normalmente a partir del decaimiento radioactivo de compuestos disueltos del radio. Los gases nobles tienen muchas aplicaciones importantes en industrias como iluminación, soldadura y exploración espacial. La combinación helio-oxígeno-nitrógeno (trimix) se emplea para respirar en inmersiones de profundidad para evitar que los buzos sufran el efecto narcótico del nitrógeno. Después de verse los riesgos causados por la inflamabilidad del hidrógeno, éste fue reemplazado por helio en los dirigibles y globos aerostáticos.

Periodos
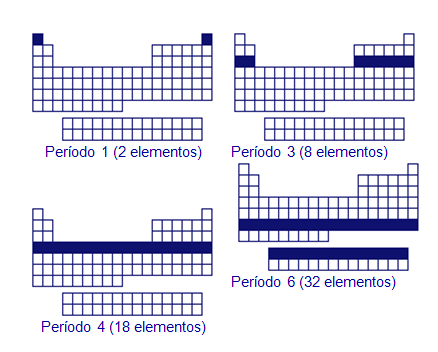
En la tabla periódica los elementos están ordenados de forma que aquellos con propiedades químicas semejantes, se encuentren situados cerca uno de otro.Los elementos se distribuyen en filas horizontales, llamadas períodos. Pero los periodos no son todos iguales, sino que el número de elementos que contienen va cambiando, aumentando al bajar en la tabla periódica.
El primer periodo tiene sólo dos elementos, el segundo y tercer periodo tienen ocho elementos, el cuarto y quinto periodos tienen dieciocho, el sexto periodo tiene treinta y dos elementos, y el séptimo no tiene los treinta y dos elementos porque está incompleto. Estos dos últimos periodos tienen catorce elementos separados, para no alargar demasiado la tabla y facilitar su trabajo con ella.
El periodo que ocupa un elemento coincide con su última capa electrónica. Es decir, un elemento con cinco capas electrónicas, estará en el quinto periodo. El hierro, por ejemplo, pertenece al cuarto periodo, ya que tiene cuatro capas electrónicas.